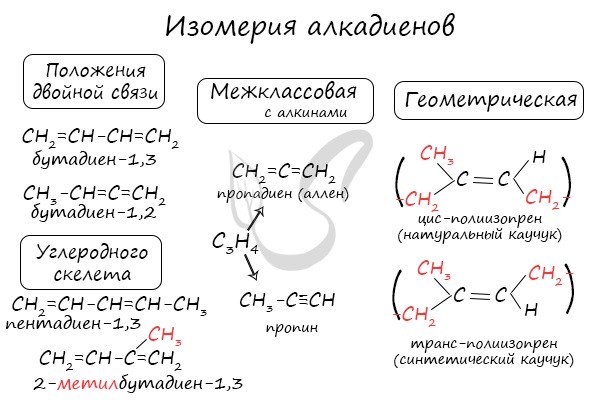
Аллены - класс органических соединений с двумя кумулированными двойными связями. В данной статье вы узнаете о структуре, физических свойствах и реакционной способности алленов. Также рассмотрены история открытия, производство и применение этих соединений. Читайте на Ласточка-Коломна.
Cодержание
Введение
В данной статье рассматривается класс органических соединений, известных как аллены. Аллены представляют собой углеводороды и их замещенные производные с двумя двойными связями у одного атома углерода. Родоначальником этого класса является аллен CH2=C=CH2, также известный как пропадиен. Аллены обладают особыми химическими свойствами и широко применяются в различных областях.

История открытия
Пропадиен, первый представитель класса алленов, был синтезирован русскими учеными Г. Г. Густавсоном и Н. Я. Демьяновым в 1883 году. Они получили его действием цинковой пыли на 2,3-дихлорпропен. Этот метод позволил также получить и другие представители гомологического ряда алленов.
Структура и физические свойства
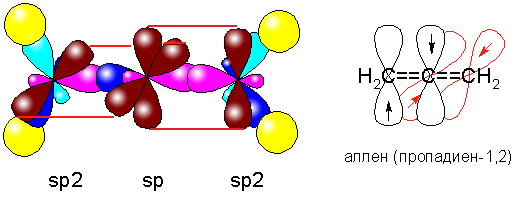
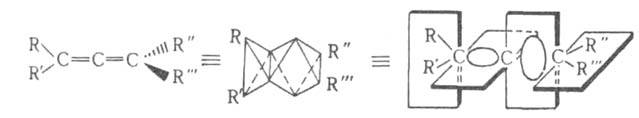
Особенностью алленов является наличие двух кумулированных двойных связей. Центральный атом углерода в алленах находится в состоянии sp-гибридизации, а крайние атомы - в состоянии sp². Это приводит к линейности системы кумулированных связей и взаимной перпендикулярности π-связей и концевых заместителей. Аллены могут образовывать асимметрично замещенные энантиомеры, обладающие аксиальной хиральностью.
См. также
Реакционная способность
Центральный атом углерода в алленах обладает электрофильной реакционной способностью. Аллены могут вступать в реакции электрофильного присоединения, причем направление присоединения электрофила зависит от природы реагентов. Также аллены могут претерпевать прототропные перегруппировки, превращаясь в 1,3-диены или алкины.

Производство и применение
Пропадиен, основной представитель алленов, производится с хорошим выходом. Синтез начинается с аллилбромида, который превращается в 1,2,3-трибромпропан и затем в пропадиен. Пропадиен используется в сварочных смесях и для производства инсектицидов.

Равновесие с метилацетиленом
Пропадиен существует в равновесии со своим изомером метилацетиленом. Это равновесие может быть важным фактором при производстве пропена и может влиять на полимеризацию пропена при использовании катализаторов.
См. также
Какие системы охлаждения используются в холодильниках?
Заключение
Аллены представляют собой уникальный класс органических соединений с двумя кумулированными двойными связями. Их особенности структуры и реакционной способности делают их важными соединениями в органическом синтезе и промышленности.

Что нам скажет Википедия?
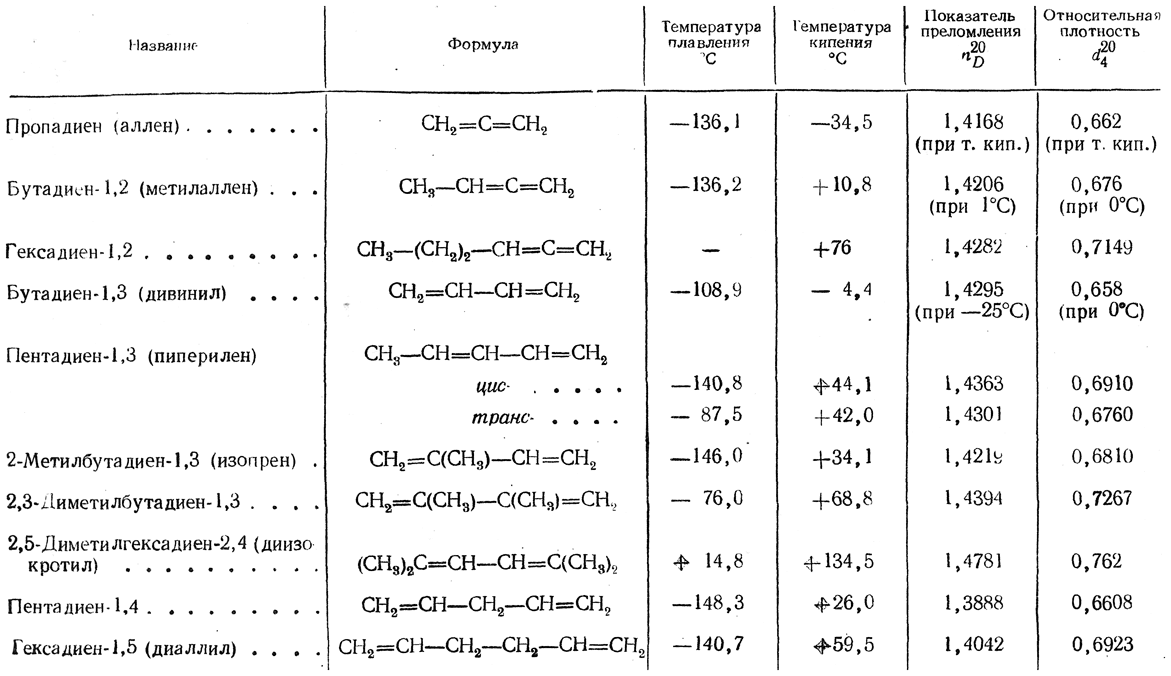
Аллены, 1,2-диены — углеводороды и их замещенные производные с двумя двойными связями у одного атома углерода общей формулы RR'C=C=CR''R''', где R, R', R'', R''' — Н, алкильный, арильный, гетероарильный заместитель либо функциональная группа. Родоначальник гомологического ряда, давший название классу — аллен CH2=C=CH2 (пропадиен). Аллены — простейшие представители класса гомокумуленов.
Пропадиен впервые был синтезирован русскими учёными Г. Г. Густавсоном и Н. Я. Демьяновым в 1883 году действием цинковой пыли на 2,3-дихлорпропен. Этим методом удалось получить и другие представители гомологического ряда алленов.
Особенностью алленов, определяющей их химические свойства, является наличие двух кумулированных двойных связей, где центральный атом углерода находится в состоянии sp-гибридизации, а крайние — в состоянии sp². Следствием такой гибридизации является линейность системы кумулированных связей и взаимная перпендикулярность π-связей и концевых заместителей. Следствием этого является аксиальная хиральность (точечная группа D2d) асимметрично замещённых алленов, образующих энантиомеры. Впервые на эту возможность указал Я. Х. Вант-Гофф ещё в 1874 году, хотя в то время аллены ещё не были известны. Первые хиральные аллены получили в 1935 году независимо друг от друга Э. Колер и Г. Миллс — оптически активные дифенил-ди-α-нафтилаллен и эфир 1,3-дифенил-1-α-нафтилаллен-3-карбоновой кислоты с гликолевой кислотой.
В ИК-спектрах алленов присутствует характеристическая полоса при 1950 см−1.
Центральный sp-гибридизованный атом углерода в алленах является электрофильным центром, реакционная способность усиливается электроноакцепторными группами; такие соединения легко присоединяют по двойной связи нуклеофилы NuH:
Подобно алкенам, аллены вступают в реакции электрофильного присоединения, направление присоединения электрофила неоднозначно и зависит от природы реагентов. Так, при хлорировании аллена в воде хлор присоединяется к центральному кумуленовому атому углерода:
В то же время при гидратации аллена в условиях кислотного катализа присоединение протона идёт по терминальному углероду, образующийся при этом енол далее таутомеризуется в ацетон:
Под действием щелочей или кислот аллены могут претерпевать прототропные перегруппировки в 1,3-диены:
или в алкины (ацетилен-алленовая перегруппировка):
Аллены способны димеризоваться, образуя циклобутаны, так, аллен при димеразации даёт смесь 1,2- и 1,3-диметиленциклобутанов, при низких температурах преобладает первый изомер, доля второго растёт при повышении температуры.
Аллены могут быть синтезированы взаимодействием реактивов Гриньяра с пропаргилгалогенидами в присутствии FeCl3:
аналогично протекает реакция пропаргилацетатов с диалкилкупратами лития:
Другим методом синтеза алленов является дегалогенирование гем-дигалогенциклопропанов магнием или метил- либо бутиллитием, идущее через перегруппировку промежуточно образующегося карбена (реакция Деринга):
Поскольку гем-дигалогенциклопропаны могут быть получены присоединением дигалогенкарбенов к алкенам, то обработка алкена бромоформом в присутствии сильного основания (например, трет-бутилата калия) с дальнейшей обработкой магнием образующегося дибромциклопропана служит методом превращения алкенов в аллены «внедрением» атома углерода в олефиновую двойную связь:
в некоторых случаях такое превращение можно провести в одну стадию, используя один эквивалент бромоформа и два эквивалента основания.
См. также
Литература
Примечания



![АлленСодержание а также Структура и свойства [ править ]](https://upload.wikimedia.org/wikipedia/commons/thumb/a/aa/Allene.png/220px-Allene.png)